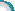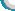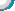【摘要】 目的:观察不同培养环境对小鼠视网膜神经细胞的影响。方法: 分别培养新生小鼠的视网膜神经细胞和色素上皮细胞,并纯化培养视网膜神经节细胞,将纯化和未纯化的视网膜神经细胞分别与视网膜色素上皮细胞接触和分层共培养,相差显微镜观察视网膜神经细胞在不同培养模式中的表现。结果:混合培养的视网膜神经细胞较纯化培养的神经节细胞生存时间长,突触联系多。与视网膜色素上皮细胞共培养时,神经细胞的存活时间进一步延长,突触联系增多,但是神经细胞在与视网膜色素上皮细胞分层和接触共培养的两种模式中,显示出了不同的细胞形态。结论:视网膜神经胶质细胞和视网膜色素上皮细胞不但对神经节细胞具有滋养作用,细胞间的立体结构关系可能还影响着细胞的成熟分化。
【关键词】 视网膜神经节细胞;视网膜色素上皮细胞;共培养
Appearance of murine retinal neural cell in different culture systems
YuPing Zheng, ZhaoHui Feng, LuYan Zhang, HuaNing She, XiaoHua Wang, QuanChen Xiong
Foundation item: National Natural Science Foundation of China (No.30772598)
Department of Ophthalmology, the Second Hospital of Medical College of Xian Jiaotong University, Xian 710004, Shaanxi Province, China
AbstractAIM: To explore the effect of different culture environments on murine retinal neural cells.
METHODS: Neonatal murine retinal neural cells, purified retinal ganglion cells and pigment epithelial cells were cultured. Purified and unpurified retinal ganglion cells were cultured with RPE in contacting or uncontacting modes. Appearance of neural cells was observed under phasecontrast microscope.
RESULTS: Compared with purified ganglion cells, mixed retinal neural cells survived longer and had more synapse. Being cultured with RPE further, both mixed retinal neural cells and purified ganglion cells had longer survive time and more synapse. However, neural cells in contacting mode showed different appearance.
CONCLUSION: In addition to providing nourishment to retinal ganglion cells, retinal glial cells and pigment epithelial cells also affect the differentiation and maturation of retinal neural cells by their stereostructures.
KEYWORDS: retinal ganglion cell; retinal pigment epithelium; coculture
Zheng YP, Feng ZH, Zhang LY, et al. Appearance of murine retinal neural cell in different culture systems. Int J Ophthalmol(Guoji
Yanke Zazhi)2008;8(11):
0引言
视网膜神经细胞,尤其是视网膜神经节细胞( retinal ganglion cells, RGCs)的损伤和死亡,是多种眼底疾病导致失明的共同病变[1]。在本研究中,我们对新生小鼠的视网膜神经细胞在不同的培养模式中进行培养,希望能找到一种与体内环境非常类似的视网膜神经细胞培养体系,从而了解细胞在正常和病理状态下的生物学表现,为遏制视网膜神经病变提供基础。
1材料和方法
1.1材料 C578L/6N小鼠,生后1d和出生后2wk的乳鼠,由本校实验动物中心提供。DMEM/F12培养液(Gibco公司),胎牛血清(Hyclone 公司)。大鼠抗小鼠Thy1 单克隆抗体(Santa Cruz 公司),小鼠抗小鼠 cytokeratin多克隆抗体(博士德公司),羊抗鼠IgGTR(Santa Cruz 公司)。
1.2方法
1.2.1视网膜神经细胞的混合培养与鉴定 取出生1d 乳鼠浸泡于体积分数为750mL/L的酒精中处死后,在无菌状态下挖出眼球,将眼球置入盛有无血清培养液的培养皿中,去除球周筋膜组织,将眼球置于10g/L胰酶和70000U/L胶原酶的DMEM中中60min,PBS洗净后切开眼球,此时玻璃体液化,视网膜神经组织可自动从色素上皮脱离,将分离到的视网膜组织收集于离心管中,加入1.25g/L的胰蛋白酶37℃进行水浴消化15min ,其间摇动离心管2~3次,之后加入血清终止消化,800r/min离心5min ,吸去上清液,加培养液吹打数次后再离心,加入含200g/L胎牛血清的DMEM/F 12培养液,制成视网膜神经细胞混合悬液,细胞计数后以1×108/L 接种于事先用5mg/L 多聚赖氨酸包被的24孔培养板(部分孔内放置细胞爬片),入37℃、体积分数为5%的二氧化碳培养箱培养。24h 后加入10μmol/L的阿糖胞苷以抑制非神经细胞的增殖, 阿糖胞苷作用24h后换液。神经节细胞用Thy1进行鉴定。
1.2.2视网膜神经节细胞的纯化培养与鉴定 参照文献2~3[2,3],略有改变。用Thy1 单克隆抗体包被培养皿,以PBS稀释单克隆抗体Thy1(1∶100),置4℃过夜,用PBS洗3次。将以上得到的视网膜神经细胞悬液接种于包被有单克隆抗体的培养皿内,入37℃、50mL/L的二氧化碳培养箱培养,1h后,每隔15min轻轻摇动1次,2h后吸去培养液,用37℃的DMEM/ F12培养液冲洗培养皿3~4次,以洗去未吸附的细胞,将吸附的细胞用胶原酶消化下来(37℃ 15min),制成1×108/L细胞悬液,在以下各个培养模式中分别接种。部分接种24孔培养板中的细胞爬片上用以染色鉴定。
1.2.3视网膜色素上皮细胞的培养与鉴定 取出生2wk的乳鼠,分离视网膜神经上皮的方法同以上。将已去除视网膜神经上皮的眼杯平铺,滴加1.25g/L的胰酶覆盖其表面,37℃消化30min后,用100μL的移液枪头轻轻吹打色素上皮面,使色素上皮细胞脱落,加 100g/L DMEM培养液,离心后,细胞计数以1×109/L接种,培养。
1.2.4细胞培养模式 分以下6种模式进行培养:(1)培养A组:未纯化的视网膜神经细胞混合培养;(2)培养B组:视网膜神经节细胞纯化培养; (3)培养C组:未纯化的视网膜神经细胞和视网膜色素上皮细胞在transwell培养板中分层共培养;(4)培养D组:未纯化的视网膜神经细胞接种到已经有视网膜色素上皮细胞生长融合的培养板中,接触共培养。(5)培养E组:纯化的视网膜神经节细胞和视网膜色素上皮细胞在transwell培养板中分层共培养。(6)培养F组:纯化的视网膜神经节细胞接种到已经有视网膜色素细胞生长融合的培养板中,接触共培养。
1.2.5观察指标 每天倒置相差显微镜下观察细胞及其突起的生长情况以及细胞之间的连接情况并照相。
2结果
2.1神经节细胞的鉴定 用神经节细胞的特异标志Thy1染色检测,没有纯化的视网膜神经细胞混合培养时,神经节细胞的阳性率约为50%。而用Thy1 单克隆抗体吸附纯化后,神经节细胞的阳性率在90%以上(图1,2)。
2.2视网膜色素上皮细胞的鉴定 小鼠视网膜色素上皮细胞2~4d左右贴壁,1wk左右融合成片,用cytokeratin染色鉴定,阳性率为100%。
2.3视网膜神经细胞在不同培养模式中的形态表现 (1)没有纯化的视网膜神经细胞1d左右可见贴壁,细胞聚集成簇的现象明显,3d后可见细胞间有较丰富的突触联系,但突触联系主要发生在成簇生长的细胞间(图3),经Thy1染色,证实发出较长轴突的并不是神经节细胞(图1)。所有细胞胞体的形态比较一致,但不成熟。细胞可存活 3wk左右。(2)纯化后的视网膜神经节细胞在1d左右贴壁,细胞分散,单独培养时只有少量的细胞可见有突起伸出,细胞只能存活3d左右(图4)。(3)未纯化的视网膜神经细胞和原代RPE细胞分层共培养时,细胞仍然聚集成簇,细胞的突触明显增长,单个细胞间也出现突触联系,但细胞的形态还不成熟,胞体形态基本一致,细胞存活3wk左右(图5)。(4)未纯化的视网膜神经细胞和原代RPE细胞接触共培养时,细胞仍有聚集成簇的现象,但细胞的形态,尤其是胞体的形态呈多样化改变,显示出了细胞的异质性,细胞的突触变长和联系增多的同时,亦变得粗壮(图6),发生在单个细胞间的突触联系明显增多。细胞可以存活5wk以上。 (5)纯化的视网膜神经节细胞和原代RPE细胞分层共培养时,细胞的突起略有增长,但突触联系仍不明显,细胞的存活时间变长,1wk左右死亡(图7)。(6)纯化的视网膜神经节细胞和原代RPE细胞接触共培养时,细胞的轴突明显变长,出现突触联系。细胞的存活时间在2wk左右(图8)。
3讨论
视网膜神经节细胞的离体培养是研究其生理特性的重要手段[3]。目前视网膜神经节细胞的培养方法主要有视网膜神经细胞的混合培养和神经节细胞的纯化培养两种。混合培养对取材动物的年龄要求较严,通常是取胎鼠或出生3d以内乳鼠的视网膜,因为此时视网膜尚未分层,RGC的数量较多,文献报道混合培养中RGC的含量从50%~80%不等[4,5]。纯化培养的方法有多种,其中以Thy1单克隆抗体免疫吸附法最好,这种方法是利用视网膜节细胞表面的特异性抗原能够与特异性抗体产生结合反应,运用抗体捕捉细胞进行培养,通过吸附纯化得到的细胞特异性高,破损率小,成活率高[2,3]。但是视网膜神经节细胞在混合和纯化培养时有不同的存活形态和时间,说明不同的培养方式对细胞的生物特性影响较大 ,而这种影响主要来自于其周围滋养细胞。
视网膜神经胶质细胞和色素上皮细胞是视网膜神经元细胞的主要滋养来源[6,7]。将来源于视网膜神经上皮的细胞混合培养时,其中的神经节细胞较纯化的神经节细胞存活时间延长,突触联系增多,这说明了神经胶质细胞在节细胞生长中的重要性,但是在神经上皮细胞单独培养体系中,所有细胞的形态一致,没有显示出继续分化,成熟的迹象,即使将这些细胞和视网膜色素上皮细胞分层共培养,接受到色素上皮细胞的物质滋养来源,细胞也仅是在存活时间和轴突长短上有进一步的延长,仍未走向成熟分化[8]。
视网膜组织在体内有着特殊的组成和分层样立体结构,因此我们进一步将神经细胞接种在已经融合成层的色素上皮细胞上,从而使细胞在一个立体结构上也与体内相似的环境中生长。在这种分层接触共培养的体系中,视网膜神经细胞不仅突触联系增多,突触联系的形式也多发生在单个细胞间,表现出了一种与体内相似的神经细胞间的信号传递方式,而且细胞形态发生了多样化的改变,显示出了细胞分化后的异质性[9]。遗憾的是,接种在色素上皮细胞上的神经细胞与其下层细胞的连接非常疏松,染色过程中的轻微漂洗便可使其脱落,因此尚无法对这些细胞的分化走向进行定性。尽管如此,视网膜神经节细胞在各不同环境中的表现差异提示了细胞的离体培养环境对细胞生物学特性的影响,这种影响可能会导致对细胞各种性能的差别理解。
图1出生1d天的乳鼠视网膜神经上皮细胞混合培养1wk时,Thy-1染色标记神经节细胞,神经节细胞的阳性率在50%左右,部分神经节细胞有轴突伸出和联系,但有较长轴突的细胞并不是神经节细胞(bar=20mm) 图2 纯化的视网膜神经节细胞培养2d时Thy1染色,可见细胞的阳性着染率在90% 以上,胞浆和细小的突起呈阳性着色 图3相差显微镜下,来源于出生1d乳鼠视网膜神经上皮的细胞混合培养1wk,细胞胞体形态一致,有突触联系,但突触联系发生在成簇生长的细胞间(bar=20mm) 图4用Thy1单克隆抗体吸附纯化的神经节细胞培养2d时,可见细胞分散,有细小的突起伸出(bar=10mm) 图5未纯化的视网膜神经细胞与视网膜色素上皮细胞分层共培养1wk时,可见细胞间的突触联系增多,单个细胞间也出现突触联系,但细胞胞体的形态仍基本一致(bar=20μm) 图6未纯化的视网膜神经细胞与视网膜色素上皮细胞接触共培养1wk时,可见视网膜神经细胞疏松贴附于融合成层的色素上皮上,立体感强,单个细胞间的突触联系增多,而且细胞胞体的形态不一致,发生了较大变化(bar=20μm) 图7纯化的视网膜神经节细胞和视网膜色素上皮细胞分层共培养3d时,细胞伸出的突起略长于细胞单独培养时(bar=10μm) 图8纯化的视网膜神经节细胞和视网膜色素上皮细胞接触共培养3d时,神经节细胞的突触明显变长,细胞间的突触联系增多(bar=10μm)
【参考文献】
1 Shatz CJ, OLeary DD. Repair and replacement to restore sight. Report from the Panel on Ganglion Cell/Connectivity. Arch Ophthalmol1993;111(4):472 477
2 Lindsey JD , Weinreb RN. Survival and differentiation of purified retinal ganglion cells in a chemically defined microenvironment. Invest Ophthalmol
Vis Sci1994;35:36403648
3 Takahashi N, Cummins D, Caprioli J. Rat retinal ganglion cells in culture. Exp Eye Res1991;53(5):565 572
4 Sernagor E, Eglen SJ, Wong RO. Development of retinal ganglion cell structure and function. Prog Retin Eye Res2001;20(2):l39 174
5尹小磊,叶剑,陈春林.新生SD大鼠视网膜神经节细胞体外原代培养.国际眼科杂志2006;6(5):1008 1010
6 Xiong WC, Montell C. Defective glia Induce neuronal apoptosis in the repo visual system of drosophila. Neurology1995;14:581590
7 Bahr M, Przyrembel C, Bastmeyer M. Astrocytes from adult rat optic nerves are nonpermissive for regenerating retinal ganglion cell axons. Exp Neurol1995;131(2):211
8 Hrisch S, Bahr M. Immunocytochemical characterization of reactive optic nerve astrocytes and meningeal cells. Glia1999;26(1):36
9 Lu SH, Liu L. Pharmacological neuroprotection on retinal ganglion cells. Int J Ophthalmol(Guoji Yanke Zazhi) 2008;8(3):568570
|